CRISTALOGRAFIA
CRISTALOGRAFIA
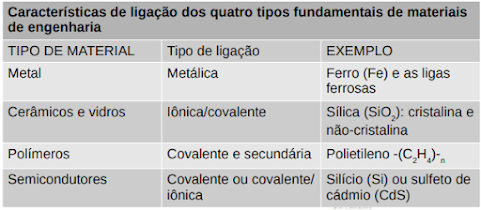
LIGAÇÕES ATÔMICAS
* Ligação Covalente
A ligação covalente é aquela em que os átomos dos elementos químicos compartilham seus elétrons a fim de ficarem estáveis, ocorre entre átomos de hidrogênio, ametais e semimetais.
Exemplos de ligações covalentes:
* Ligação Metálica
* Ligação secundária
ou van der Waals
* Cristais Covalentes
* Ligação Metálica
As ligações metálicas, também conhecidas como ligas metálicas, são ligações químicas que ocorrem entre átomos de metais que fluem livremente por uma camada cristalina bem definida.
São forças de ligação secundária que atuam entre moléculas e entre átomos estáveis como os gases nobres. As temperaturas de ebulição e de fusão destes materiais (moleculares ou átomos de gases nobres) estão associadas à intensidade destas forças.
ESTRUTURA CRISTALINA
* Ordenação de átomos
Os materiais sólidos podem ser classificados de acordo com a regularidade na qual os átomos ou íons se dispõem em relação
à seus vizinhos, considerando ângulos, distâncias e simetria da ordenação.
* Célula Unitária
O número de átomos por célula unitária é o número específico de pontos da rede que define cada célula unitária. Um ponto no vértice da célula unitária cúbica é partilhado por oito células unitárias do arredor; assim, somente 1/8 de cada vértice pertence a uma
célula particular. No centro da face é compartilhado por 2 células unitárias.
* Direções e Planos nos Cristais
Algumas direções da célula unitária são de particular importância, por exemplo os metais se
deformam ao longo da direção de maior empacotamento. Muitas propriedades dos materiais
dependem da direção do cristal em que se encontram e são medidas.
Íncides de Miller para direções:
1. Definir dois pontos por onde passa a direção
2. Definir o ponto alvo e origem, fazendo-se: alvo-origem
3. Eliminar as frações e reduzir ao m.m.c.
4. Escrever entre colchetes, e se houver n° negativo o sinal é colocado sobre o n°
FATOR DE EMPACOTAMENTO LINEAR: É quanto da direção está
definitivamente coberta por átomos.
* Metais
Os metais cristalizam preferencialmente em sistemas cúbico(CCC, CFC) ou hexagonal (HC). Metais não cristalizam no
sistema hexagonal simples, pois o fator de empacotamento é muito baixo.
* Cristais Iônicos
Modelo matemático da estrutura cristalina de cristais iônicos = cálculo de propriedades do cristal: energia de ligação e espaçamento de
equilíbrio dos íons no cristal
Estrutura do diamante
- Ocupação dos interstícios
- Totalmente covalente
- Forma metaestável















Comentários
Postar um comentário